


 微信在线咨询
微信在线咨询

| 产品编号 | 产品名称 | 产品包装 | 产品价格 |
| P0017FFT | BeyoBlue™考马斯亮蓝超快染色液(试用装) | 50ml | .00元 |
| P0017F | BeyoBlue™考马斯亮蓝超快染色液 | 250ml | 185.00元 |
BeyoBlue™考马斯亮蓝超快染色液(BeyoBlue™ Coomassie Blue Super Fast Staining Solution)是碧云天最新研发的快速、高效、无污染、高灵敏度、使用便捷的以考马斯亮蓝G250为染料的染色液,可用于SDS-PAGE或非变性PAGE等蛋白凝胶的染色,或Western转膜后PAGE胶上残余蛋白的检测。10分钟即可检测到100ng条带,30分钟可检测到50ng条带,后续适当脱色后可以检测到20ng条带。
染色超快速,检测灵敏度高。凝胶在电泳结束后无须任额外步骤,直接用本染色液染色10分钟,肉眼可见低至100ng的蛋白条带,并且可以清晰观察到诱导表达的目的蛋白条带,染色30分钟肉眼可见低至50ng蛋白条带(参考图1)。对于1毫米厚度的凝胶,染色30分钟后用水脱色1-2小时可以获得背景很低的凝胶,用水脱色过夜可以获得背景如水晶般晶莹剔透的凝胶(参考图1)。对于1.5毫米厚度凝胶,染色30分钟也可以检测到低至50ng条带,但为了彻底去除染色背景,需要将染色时间延长至60分钟,然后用水脱色1-2小时可获得背景很低的凝胶,用水脱色过夜也可获得背景如水晶般晶莹剔透的凝胶。
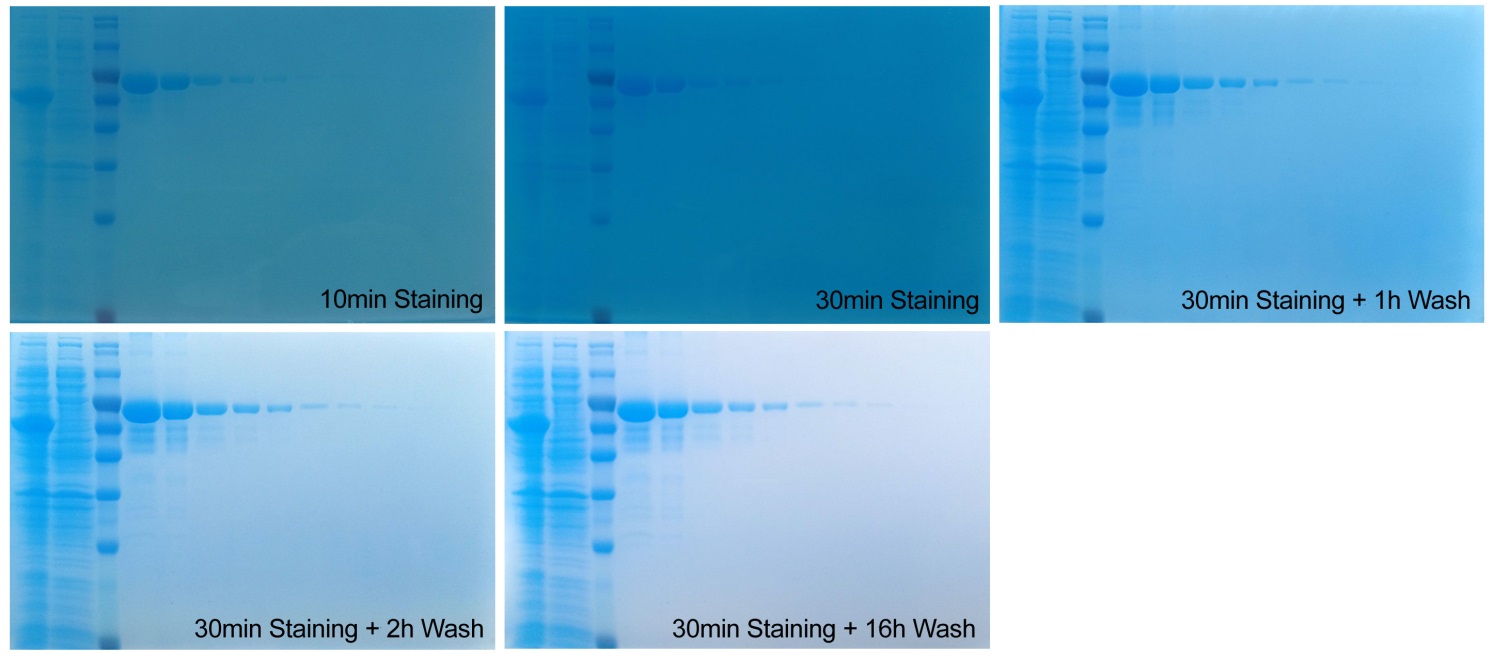
图1. 1毫米厚蛋白凝胶染色效果图。(A-B)蛋白凝胶电泳后染色10分钟(A)和30分钟(B)的实拍效果图。(C-E)染色30分钟后,用水脱色1小时(C)、2小时(D)和脱色16小时(E)的实拍效果图。蛋白凝胶中从左到右依次为分子量为55kD的目的蛋白诱导后和诱导前细菌总蛋白裂解液,预染蛋白分子量标准(P0075/P0076/P0077),上样量依次为10μg、5μg、2μg、1μg、500ng、200ng、100ng、50ng、30ng、20ng、10ng的BSA。染色30分钟后肉眼可见50ng蛋白条带。
无污染,无毒无刺激性。本BeyoBlue™考马斯亮蓝超快染色液是一种无毒,无刺激性气味的高度环保型染色液。普通的常规方法需使用剧毒的甲醇及强刺激性的乙酸,而碧云天生产的BeyoBlue™考马斯亮蓝超快染色液是在高度环保型考马斯亮蓝快速染色液(P0017)基础上进一步优化,不仅实现了染色时的无毒和无刺激性气味,并且染色更快,灵敏度更高,背景更低,无需煮沸、无需染色前充分洗胶等额外操作,使用更加便捷。
本产品可以进行高灵敏染色(详细请参考使用说明),最低可以清晰检测到20ng的蛋白电泳条带,参考图1。
无需固定、无需煮沸,可不脱色或用水脱色,操作便捷。无需对蛋白凝胶进行固定,无需进行煮沸以加快洗涤、染色或脱色,不脱色即可观察到清晰的蛋白条带,用水即可进行脱色以获得无色透明的背景,操作非常便捷。
兼容质谱分析。本染色液和质谱分析兼容,即经过本染色液染色的蛋白条带或蛋白点与常规的考马斯亮蓝G250染色一样,可以用于后续的质谱分析。
包装清单:
| 产品编号 | 产品名称 | 包装 |
| P0017F | BeyoBlue™考马斯亮蓝超快染色液 | 125ml×2 |
| — | 说明书 | 1份 |
保存条件:
4℃避光保存,一年有效。
注意事项:
本染色液呈酸性,有轻微腐蚀性,使用时请作必要防护。
需自备去离子水或双蒸水。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:
1. 染色:常规大小凝胶在蛋白电泳后,用去离子水稍微润洗一下,小心倒掉液体,加入约20ml超快染色液,染色10-60min。加入适量的BeyoBlue™考马斯亮蓝超快染色液(每块大小约7×8厘米的凝胶需使用约20ml),使染色液能盖住凝胶,且液面至少高出三个胶的厚度为宜,室温(20-25℃)在侧摆摇床或水平摇床上进行染色。在室温的染色时间宜为30min,实际染色时间可以根据染色效果自行调整。染色至能看到清晰的目标蛋白条带后,弃染色液,加入适量的去离子水,洗去残留的染色液,停止染色反应,然后即可拍照记录。如果希望获得没有背景的凝胶图片,可以进行后续的脱色步骤。通常染色10min就可以观察到100ng左右的蛋白条带,染色30min就可以观察到50ng左右的蛋白条带。1毫米厚度凝胶推荐的染色时间为30min,1.5毫米厚度凝胶推荐的染色时间为60min,简单查看蛋白染色效果时染色10min就可以了。
2. 脱色:加入适量去离子水,在摇床上摇动脱色。每隔约10-30min,更换新的去离子水,继续在摇床上脱色。通常用去离子水脱色30min即可获得比较低的背景;脱色2小时可见约30ng的蛋白条带,而且可获得几乎无色透明的背景;脱色2小时后,再加入约100ml去离子水将凝胶脱色过夜(可以静止浸泡过夜或摇床上缓慢摇动脱色过夜),可以获得更加清晰的蛋白条带并完全去除染色背景。
注:上述的洗涤、染色和脱色时间均适用于0.75-1.5毫米厚的凝胶,对于更厚的凝胶,染色和脱色的时间均须适当延长。
常见问题:
1. 无染色条带:可能上样量太少,建议电泳时上样适量的BSA等作为阳性对照。
2. 背景太高:可以在完成染色后,参考脱色步骤多次更换去离子水反复进行脱色,例如可以每隔5-10min更换一次去离子水。另外,在去离子水中浸泡过夜,通常也可以非常有效地降低背景,并取得良好的脱色效果。
3. 染色条带的灵敏度不够理想:请确认BeyoBlue™考马斯亮蓝超快染色液的染色时间是否达到了30min。如果染色时间过短,完全可能导致条带的检测灵敏度不太够。也可以考虑使用BeyoBlue™考马斯亮蓝超快染色液进行第二次染色,再次染色可以改善染色效果。适当延长染色时间也可以提高检测灵敏度并降低背景,另外用去离子水充分脱色也可以降低染色背景并显著提高染色的灵敏度。
相关产品:
| 产品编号 | 产品名称 | 包装 |
| P0017 | 考马斯亮蓝快速染色液 | 250ml |
| P0017A | 考马斯亮蓝染色试剂盒(常规法) | 1盒 |
| P0017B | 考马斯亮蓝染色液(常规法) | 250ml |
| P0017C | 考马斯亮蓝染色脱色液(常规法) | 500ml |
| P0017F | BeyoBlue™考马斯亮蓝超快染色液 | 250ml |
| P0017S | 快速银染试剂盒 | 25次 |









 微信在线咨询
微信在线咨询












