


 微信在线咨询
微信在线咨询

| 产品编号 | 产品名称 | 产品包装 | 产品价格 |
| P2271-0.5ml | Anti-Flag Affinity Gel (Anti-Flag亲和凝胶) | 0.5ml | 955.00元 |
| P2271-2ml | Anti-Flag Affinity Gel (Anti-Flag亲和凝胶) | 2ml | 2868.00元 |
| P2271-10ml | Anti-Flag Affinity Gel (Anti-Flag亲和凝胶) | 10ml | 11262.00元 |
碧云天生产的Anti-Flag Affinity Gel (Anti-Flag亲和凝胶)由高质量的鼠源Flag抗体与琼脂糖共价偶联而成,可与常规蛋白表达系统(如细菌、酵母或哺乳动物细胞)中含有Flag标签的蛋白结合,从而用于带有Flag标签的融合蛋白或蛋白复合物的纯化或免疫沉淀(Immunoprecipitation, IP)。
Flag标签(Flag-tag)、Myc标签(Myc-tag)、HA标签(HA-tag)、His标签(His-tag)和GST标签(GST-tag)等是商品化表达载体上的最常见的标签,通过此类标签的表达可方便的检测目的蛋白的表达及其功能或者用于融合蛋白的纯化。Flag-tag是8个氨基酸残基(DYKDDDDK)组成的多肽,常用的形式有Flag和3X Flag,通过基因工程技术把Flag-tag的核酸序列与目的基因的N端或C端连接。Flag-tag具有以下优点:Flag-tag通常不会与目的蛋白相互作用并且不会影响目的蛋白的功能、性质,这样就有利于对融合蛋白进行下游研究;Flag-tag作为标签蛋白,后续通过Flag抗体或Anti-Flag亲和凝胶即可对目的基因的表达、定位及功能进行检测或对目的蛋白进行纯化、免疫沉淀等;融合在N端的Flag,可被肠激酶(Enterokinase, EK)切除(DDDK),从而得到特异的目的蛋白。基于以上优点,Flag标签已广泛的应用于蛋白表达、纯化、鉴定、功能研究及其蛋白相互作用等相关领域。
Anti-Flag Affinity Gel (Anti-Flag亲和凝胶),也被称为Anti-DYKDDDDK Affinity Gel/Beads/Resin,可特异性地结合Flag融合蛋白,广泛应用于带有Flag标签的融合蛋白或蛋白复合物的纯化或免疫沉淀等实验。
本产品有较高的融合蛋白结合量、特异性强:每ml纯凝胶(settled gel)含有约8mg Flag抗体,可结合约1mg融合蛋白,且特异性强,非特异的杂蛋白结合少。
本产品可结合多种形式的Flag标签蛋白:本产品可特异性地结合甲硫氨酸修饰的N端Flag融合蛋白(Met-Flag-Protein)、N端Flag融合蛋白(Flag-Protein)、C端Flag融合蛋白(Protein-Flag)或中间带有Flag的融合蛋白。
本产品可选择多种洗脱方法:本产品根据蛋白结构的完整性、生物功能及后续应用的要求,可使用多种洗脱方法,包括Flag多肽、酸性、碱性、中性和SDS-PAGE上样缓冲液等洗脱液进行洗脱。特别是Flag多肽洗脱后不包含抗体的轻链和重链,可以有效解决免疫沉淀后Western实验中轻链和重链的干扰问题。
本产品可重复使用多次,性价比高:在正常情况下,本产品用于相同蛋白的纯化时可回收使用4-10次。如果用于免疫共沉淀检测蛋白蛋白的相互作用,不推荐重复使用。
本产品使用方便:本产品储存在TBS缓冲液中,不含甘油,使用时无须去除甘油,而且混匀和吸取都非常方便,吸取损失也较少。
本产品用于纯化E. coli中Flag融合蛋白的效果可以参考图1。
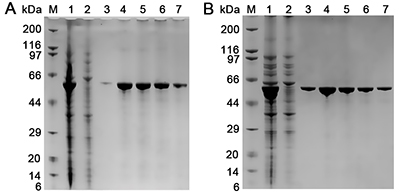
图1. 本产品用于纯化E. coli中Flag融合蛋白的效果图。A. M:marker;1:细菌裂解液(cell lysate);2:上样流穿液(flow through);3-7:碱性(pH12.0)洗脱法时各洗脱液。B. M:marker;1:细菌裂解液(cell lysate);2:上样流穿液(flow through);3-7:3X Flag竞争洗脱法时各洗脱液。注:实际的电泳结果会因样品、上样量等的不同而有所不同。
本产品的主要指标如下表:
| Characteristics | Description |
| Product content | 50% settled gel in TBS with preservative |
| Matrix | 4% cross‐linked agarose |
| Average bead size | 90μm |
| Antibody | Mouse monoclonal antibody against Flag-tag, clone G1 |
| Isotype | IgG2b |
| M.W. of antibody | Approximately 150kDa |
| Antibody concentration | Approximately 8mg Flag antibody per ml settled gel |
| Binding capacity | Approximately 1mg Flag‐tagged protein per ml settled gel |
| Gel reuse | The gel can be recycled for at least 4 times. If maintained properly, the gel can be reused 10 times with minimum loss of binding capability. |
| Elution method | Acid, alkaline, neutral, peptide competitive or SDS‐PAGE loading buffer elutions. Note: If elute with SDS-PAGE loading buffer, the light (~25kDa) and heavy (~50kDa) chain of G1 antibody will be denatured and release from the gel. |
| Reagents compatibility | Compatible with commonly used reagents at certain concentrations |
| Application | Protein purification、Pull down、IP、Co-IP |
本产品可兼容多种试剂:本产品可兼容一定浓度的DTT、EDTA、常见去垢剂、盐酸胍及尿酸等试剂。具体见下表。
| Reagent | Maximum tolerable concentration | Comments |
| EDTA | 5mM | Higher concentration of chelating agent will reduce purification efficiency with less target protein recovery. |
| β‐ME、DTT | 100mM for β‐ME; 80mM for DTT | Reducing agents will reduce disulfide bonds in the G1 antibody on the gel. Avoid reducing agents or keep at low concentration (<10mM) during purification process. When the reducing agents reach the maximum tolerable concentration mentioned here, there will be bands of antibody heavy chain (~50kDa) and light chain (~25kDa) in SDS‐PAGE analysis. The gel CANNOT BE REUSED if samples containing higher concentration of reducing reagents are applied to the gel. |
| Tween 20、Triton X‐100 | 5% for Tween 20 and Triton X‐100 | The concentration of Tween 20 and Triton X‐100 should not exceed 5%. |
| SDS | Not suggested | SDS will denature the G1 antibody on the gel. |
| NP‐40 | 4% | Higher concentration of NP‐40 will reduce purification efficiency with less target protein recovery. |
| GuHCl、Urea | 0.3M for GuHCl; 1.5M for Urea | Chaotropic reagents will denature the target Flag‐tagged protein. Do not exceed 0.3M GuHCl or 1.5M Urea. |
| Glycerol | 20% | Higher concentration of glycerol will interfere with the binding of Flag tagged protein. |
| NaCl | 0.5M | Higher concentration of NaCl will reduce purification efficiency with less target protein recovery. |
本产品为50%凝胶悬液,包装体积为总体积。
包装清单:
| 产品编号 | 产品名称 | 包装 |
| P2271-0.5ml | Anti-Flag Affinity Gel (Anti-Flag亲和凝胶) | 0.5ml |
| P2271-2ml | Anti-Flag Affinity Gel (Anti-Flag亲和凝胶) | 2ml |
| P2271-10ml | Anti-Flag Affinity Gel (Anti-Flag亲和凝胶) | 10ml |
| — | 说明书 | 1份 |
保存条件:
4℃保存,一年有效。
注意事项:
本产品不含甘油,请勿冷冻保存本产品。
本产品使用前一定要充分重悬,即充分颠倒若干次使混合均匀。
本产品含有微量的防腐剂,不会影响常规的蛋白或蛋白复合物的纯化和免疫沉淀。但如果后续涉及酶活性测定,使用本产品前宜先用TBS等适当溶液洗涤凝胶3次,以充分消除防腐剂可能产生的干扰。
在免疫沉淀或纯化时,建议设计阳性和阴性对照组。
蛋白样品收集后宜尽快完成纯化工作,并应始终放置在4℃或冰浴,以减缓蛋白降解。为有效抑制蛋白降解,可以在裂解液中添加适量的蛋白酶抑制剂混合物,例如碧云天的P1025/P1026蛋白酶抑制剂混合物(细菌抽提用),或P1005/P1006蛋白酶抑制剂混合物(通用型)。
若离心不能完全除去蛋白样品中的不溶物,可以将样品溶液用0.45μm的滤膜过滤。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:
1.样品的制备(以哺乳动物细胞为例):
1)细胞裂解液的准备:以碧云天的Western及IP细胞裂解液(P0013)为例,融解裂解液,混匀。根据样品数及使用量取适当体积的裂解液,在使用前数分钟内加入PMSF,使PMSF的最终浓度为1mM。准备好的裂解液宜置于冰上或4℃存放。
注:如果使用碧云天的Western及IP细胞裂解液(P0013)则可直接使用;如果是其它溶液,需要调节pH至7-8,并且含0.15M NaCl,以减少非特异性蛋白结合。
2)对于贴壁细胞:去除培养液,用PBS、生理盐水或无血清培养液洗两遍(如果血清中的蛋白没有干扰,可以不洗)。按照6孔板每孔100-200微升裂解液的比例加入裂解液。用移液器轻轻吹打数下,使裂解液和细胞充分接触。通常裂解液接触细胞1-2秒后,细胞就会被裂解。
对于悬浮细胞:400~500×g室温离心5分钟收集细胞,吸除细胞培养液,然后用PBS重悬洗涤并离心收集细胞,重复一次。按照6孔板每孔细胞加入100-200微升裂解液的比例加入裂解液。再用手指轻弹或用移液器吹打以充分裂解细胞。充分裂解后应没有明显的细胞沉淀。如果细胞量较多,必须分装成50-100万细胞/管,然后再裂解。大团的细胞较难裂解充分,而少量的细胞由于裂解液容易和细胞充分接触,相对比较容易裂解充分。
细胞裂解液用量说明:通常6孔板每孔细胞加入100微升裂解液已经足够,但如果细胞密度非常高可以适当加大裂解液的用量到150微升或200微升;如果Flag融合蛋白的表达量比较低,可以适当降低裂解液的用量。每100万细胞用100微升Western及IP细胞裂解液裂解后获得的上清,其蛋白浓度约为2-4mg/ml,不同细胞有所不同。
3)将加入裂解液的样品放置在摇床上,冰上孵育5-30分钟。一般情况,5分钟内即可裂解完全,某些特殊细胞裂解效果差,可适当增加孵育时间。如样品太粘稠,也可以加入核酸酶处理。
4)收集裂解后的细胞:对于贴壁细胞,用细胞刮(FSCP023/FSCP029)或细胞铲(FLFT021)刮取并收集细胞;对于悬浮细胞,按照下一步骤离心。
5)4℃,12,000×g离心5-10分钟,取上清置于冰上,即可进行后续的免疫沉淀或免疫共沉淀、Flag融合蛋白的纯化等操作。如果样品不立即使用,可以分装后-80℃冻存。
2.免疫沉淀(Immunoprecipitation, IP):
根据细胞裂解液量,本Anti-Flag亲和凝胶可通过免疫沉淀法(Immunoprecipitation)、层析柱法(Column Chromatography)和批量结合法(Batch Binding)三种方法获得或纯化Flag融合蛋白。如果样品体积较小,如0.1-2ml细胞裂解液,推荐使用免疫沉淀法,此时Anti-Flag Affinity Gel的用量约10-50μl纯凝胶(20-100μl悬液);如果样品体积为50-100ml (总量不超过4mg Flag融合蛋白),推荐选用层析柱法,此时Anti-Flag Affinity Gel的用量一般为2-4ml纯凝胶;如果样品量更大,也可以使用批量结合法提纯Flag融合蛋白,该方法不使用比较耗时的层析柱,可快速并有效的纯化Flag融合蛋白。免疫沉淀法的具体步骤如下:
1)充分重悬Anti-Flag Affinity Gel (Anti-Flag亲和凝胶),尽量形成均匀的凝胶悬液。由于本产品不含甘油,所以无需洗涤。
2)一般100μl细胞裂解液中加入20μl混合均匀的凝胶悬液(以下免疫沉淀法中都以20μl凝胶悬液为例)。如有必要,裂解液不足1ml时可用TBS补足至1ml。注:使用大孔径吸头(如用剪刀剪去部分吸头)吸取凝胶悬液会比较方便。
3)冰浴并摇晃孵育1-2小时。如需提高结合效率,可4℃孵育过夜。
4)4℃,6000×g离心30秒,小心去除上清。
5)加入0.5ml TBS洗3次,冰浴并置于摇床上,每次5分钟,然后6000×g离心30秒,小心去除上清。
6)样品置于冰上用于洗脱。
3.免疫沉淀样品的洗脱:
根据蛋白质特点及Flag融合蛋白的后续实验要求,可以选择下面3种洗脱方法:
1)3X Flag竞争洗脱法:本方法为非变性法,洗脱效率高,且洗脱后的样品中不含Flag抗体的轻链和重链。
a.3X Flag多肽储存液的配制:用适量TBS溶液溶解3X Flag多肽(P9801-2mg、P9801-5mg)至5-25mg/ml,或直接使用5mg/ml的3X Flag多肽溶液(P9801-100μl、P9801-500μl)。
b.3X Flag多肽洗脱液的配制:根据样品量确定洗脱液的用量,取一定量3X Flag多肽储存液用TBS溶液进一步稀释3X Flag多肽溶液至150μg/ml。
c.每个免疫沉淀样品加入100μl 3X Flag多肽洗脱液(150μg/ml),冰浴并摇晃孵育30分钟-2小时,为了提高洗脱效率,可延长孵育时间或重复洗脱。3X Flag多肽洗脱液体积一般为凝胶悬液的5倍。
d.4℃,6000×g离心30秒,小心转移上清至新管中,上清即为洗脱的Flag融合蛋白。注意不要吸到凝胶。
e.洗脱的Flag融合蛋白置于4℃待用,或者-20℃长期保存。
2)酸性(pH3.5)洗脱法:本方法比较快速且高效。
a.溶液的配制:酸性洗脱液(0.1M Glycine-HCl, pH3.5),中和液(0.5M Tris-HCl, pH7.4, 1.5 M NaCl)。
b.每个免疫沉淀样品加入100μl酸性洗脱液,缓慢混匀并室温摇晃孵育5分钟,6000×g室温离心30秒,小心转移上清至含10μl中和液的新管中,不要吸到凝胶。注意:孵育时间不要超过15分钟。
c.洗脱的Flag融合蛋白置于4℃待用,或者-20℃长期保存。
3)用SDS-PAGE上样缓冲液洗脱:本方法为变性法,得到的样品适合SDS-PAGE电泳或WB检测。
a.SDS-PAGE上样缓冲液的配制:可以使用商业化的2X SDS-PAGE上样缓冲液(如碧云天的P0015B),但一般含有DTT等还原剂,用该上样缓冲液洗脱得到的样品中含有Flag抗体的轻链和重链。也可以自行配制不含DTT的2X SDS-PAGE上样缓冲液(125mM Tris-HCl,pH6.8,4% SDS,20%甘油,0.004%溴酚蓝)。
b.加入20μl上样缓冲液,煮沸3分钟,6000×g离心30秒,取上清进行SDS-PAGE电泳或WB检测。
注:由于上样缓冲液中SDS会破坏Flag抗体,所以洗脱后的凝胶不能重复使用。
4.层析柱法(Column Chromatography):一般50-100ml (总量不超过4mg Flag融合蛋白)的样品,使用2-4ml纯凝胶。
1)Anti-Flag亲和凝胶层析柱的准备:
a.准备层析空柱:根据样品量选取适当体积的亲和层析柱空柱管(FCL01/FCL03/FCL06/FCL12),用2-3倍柱体积的TBS或其它适合缓冲液洗柱2次。
b.装柱:充分重悬Anti-Flag亲和凝胶,确保凝胶在TBS中分散均匀,迅速吸取适量凝胶装柱。使用大孔径吸头吸取凝胶会比较方便,如果装柱量大,可直接倒入空柱。
c.平衡:用3倍柱体积的TBS洗涤3次,洗涤时须确保凝胶平面平整,并在一次洗涤依靠重力完全排空后,再进行下次洗涤。最后一次洗涤时,保留少量TBS在凝胶上层使凝胶保存湿润,勿使凝胶排空后干燥。
2)Flag融合蛋白与Anti-Flag亲和凝胶的结合:
a.上样:室温将细胞裂解液加到准备好的Anti-Flag亲和凝胶层析柱中,可通过降低上样的流速或重复上样2-3次以增加Flag融合蛋白与凝胶的结合效率。注意:重复上样时需要收集流穿液(flow through)。
b.清洗:用10-20倍柱体积的TBS清洗,以去除非特异结合的蛋白。
c.洗脱:层析柱依靠重力完全排空后,参照步骤6进行洗脱。
5.批量结合法(Batch Binding):本方法适合裂解液样品量较大,类似免疫沉淀法。
1)凝胶的准备:根据细胞裂解液量取适量经充分重悬的Anti-Flag亲和凝胶。由于本凝胶存储在TBS中,不含甘油,所以无须平衡。一般按照纯凝胶为裂解液的1/25来准备凝胶。
2)上样:将重悬好的Anti-Flag亲和凝胶迅速转移至含Flag融合蛋白的细胞裂解液中,在室温或4℃孵育1小时,孵育过程中可通过摇床或其它混匀设备使凝胶和细胞裂解液充分接触。
注1:请勿使用磁力搅拌器混匀样品,否则会对凝胶有破坏作用。
注2:可根据情况调整孵育时间,最长孵育时间可以过夜。但如果孵育时间超过3小时,细胞裂解液中要添加蛋白酶抑制剂和抗菌剂以抑制蛋白质降解及细菌的生长。
注3:可保留少量孵育前后的裂解液,通过SDS-PAGE或Western Blot确定结合效率。
3)收集凝胶:孵育完成后,可1000×g离心5分钟收集凝胶,也可将含有凝胶的样品充分重悬后通过层析柱过滤收集凝胶。
4)清洗:使用10-20倍纯凝胶体积的TBS清洗凝胶,以去除非特异结合的蛋白。
5)洗脱:参照步骤6进行洗脱。
6.层析柱法和批量结合法的洗脱:
根据蛋白特点及Flag融合蛋白的后续实验要求,可以选择下面5种洗脱方法:
1)3X Flag竞争洗脱法:
a.3X Flag多肽储存液的配制:用适量TBS溶液溶解3X Flag多肽(P9801-2mg、P9801-5mg)至5-25mg/ml,或直接使用5mg/ml的3X Flag多肽溶液(P9801-100μl、P9801-500μl)。
b.3X Flag多肽洗脱液的配制:根据样品量确定洗脱液的用量,取一定量3X Flag多肽储存液用TBS溶液进一步稀释3X Flag多肽溶液至150μg/ml。
c.对于层析柱,用三倍柱体积的3X Flag多肽洗脱液(150μg/ml)过柱,当剩余1倍体积洗脱液时,将洗脱液保留在层析柱中30-60分钟,然后再与前面2倍体积的洗脱液合并或检测后再确定合并方式。对于凝胶,加入三倍体积的3X Flag多肽洗脱液(150μg/ml),室温摇晃孵育30-60分钟,为了提高洗脱效率,可延长孵育时间或重复洗脱。
d.洗脱的Flag融合蛋白置于4℃待用,或者-20℃长期保存。
2)酸性(pH3.5)洗脱法:
a.溶液的配制:酸性洗脱液(0.1M Glycine-HCl, pH3.5),中和液(1M Tris, pH9.0)。
b.准备6个收集管,每个收集管中加入1/20柱体积的中和液,然后将6倍柱体积的酸性洗脱液分成6份依次洗脱,每份洗脱流出液置于一个收集管中,最后合并所有洗脱液或检测后再确定合并方式。如果是凝胶,室温摇晃孵育5分钟。注意:孵育时间不要超过15分钟。
c.洗脱的Flag融合蛋白置于4℃待用,或者-20℃长期保存。
3)碱性(pH12.0)洗脱法:
a.溶液的配制:碱性洗脱液(0.1M Tris, 0.5M NaCl, pH12.0),中和液(1M HCl)。
b.准备6个收集管,每个收集管中加入1/20柱体积的中和液,然后将6倍柱体积的碱性洗脱液分成6份依次洗脱,每份洗脱流出液置于一个收集管中,最后合并所有洗脱液或检测后再确定合并方式。如果是凝胶,室温摇晃孵育5分钟。注意:孵育时间不要超过15分钟。
c.洗脱的Flag融合蛋白置于4℃待用,或者-20℃长期保存。
4)碱性(pH10.5)洗脱法:本方法的pH值较小,有利于保留某些蛋白的生物活性,但洗脱效率可能会降低。
a.溶液的配制:碱性洗脱液(0.1M Tris, 0.5M NaCl, pH10.5),中和液(1M HCl)。
b.准备6个收集管,每个收集管中加入1/40柱体积的中和液,然后将6倍柱体积的碱性洗脱液分成6份依次洗脱,每份洗脱流出液置于一个收集管中,最后合并所有洗脱液或检测后再确定合并方式。如果是凝胶,室温摇晃孵育5分钟。注意:孵育时间不要超过15分钟。
c.洗脱的Flag融合蛋白置于4℃待用,或者-20℃长期保存。
5)中性(pH7.4)洗脱法:本方法利用高盐来洗脱融合蛋白。
a.溶液的配制:中性洗脱液(3M NaCl, pH7.4)。
b.用5倍柱体积的中性洗脱液洗脱。如果洗脱效率不高,NaCl浓度可以提高至4M。
c.洗脱的Flag融合蛋白置于4℃待用,或者-20℃长期保存。
7.凝胶的再平衡:融合蛋白洗脱后,凝胶即可立刻进行平衡与再生。
再平衡:洗脱完成后,用5-10倍柱体积TBS清洗3次,以防止剩余洗脱液使偶联在凝胶上的Flag抗体变性失活。
8.凝胶的再生:如果纯化相同蛋白,不用再生即可重复使用数次;如果纯化不同的蛋白,平衡后的凝胶需要按照下面步骤进行再生。
1)用2倍柱体积的再生缓冲液1 (0.1 M Tris HCl, 0.5 M NaCl, pH 8.0)清洗。
2)用2倍柱体积的再生缓冲液2 (0.1 M sodium acetate, 0.5 M NaCl, pH 4.0)清洗。
3)用3-5倍柱体积的TBS再平衡,直至达到中性pH。
9.凝胶的保存:再平衡和再生后的凝胶或层析柱可用含有防腐剂的TBS在4℃保存一段时间。注意:凝胶须保持湿润,勿使凝胶干燥。
常见问题:
| Problem | Possible Causes | Solution |
| Large amount of Flag-tagged protein found in the flow through. | Binding time is not enough. | If using batch method, increase the binding time experimentally; If using column method, use a lower flow rate when loading samples. |
| Column is overloaded. | Reduce the amount of the sample added to the gel or increase the amount of gel. | |
| Flag‐tag is not accessible to gel. | Expose the epitope tag by adding low amount of denaturant to the protein extract (dialysis may be needed before applying onto gel), or fuse Flag tag to the other terminus of the target protein. | |
| Gel has not been regenerated since last purification. | Perform gel regeneration procedure prior to binding. | |
| Reagent compatibility problem. | Dialyze the sample against TBS before purification procedure. | |
| The target protein has been degraded. |
1. Prepare fresh lysates. Avoid using frozen lysates. 2. Perform purification at lower temperature, such as 4℃. 3. Use appropriate protease inhibitors in the lysate or increase their concentrations to prevent degradation of the Flag fusion protein. |
|
| Very few or no Flag‐tagged protein exists in the eluate. | Protein is not completely eluted. | Change elution methods. |
| No target protein expressed. | Make sure the protein of interest contains the Flag-tag by Western blot or dot blot analyses. | |
| Very low protein expression level. |
1. Use larger volume of cell lysate. 2. Optimize expression conditions to raise the protein expression level. |
|
| Washes are too stringent. |
1. Reduce the number of washes. 2. Avoid adding high concentrations of NaCl to the mixture. 3. Use solutions that contain less or no detergent |
|
| Incubation times are inadequate. | Increase the incubation times with the affinity gel (from several hours to overnight). | |
| Interfering substance is present in sample. |
1. Lysates containing high concentrations of DTT, 2-mercaptoethanol, or other reducing agents may destroy antibody function, and must be avoided. 2. Excessive detergent concentrations may interfere with the antibody-antigen interaction. Detergent levels in buffers may be reduced by dilution. |
|
| Detection system is inadequate. |
If Western blot detection is used: 1. Check primary and secondary antibodies using proper controls to confirm binding and reactivity. 2. Verify that the transfer was adequate by staining the membrane with Ponceau S. 3. Use fresh detection substrate or try a different detection system. |
|
| Multiple protein bands found in the eluate. | The protein is not stable at room temperature. | Purify the target protein at lower temperature, such as 4℃. |
| Protein degradation due to proteases activity during purification process. | Add protease inhibitors to cell lysate. | |
| Non‐specific binding. |
1. Prepare cell lysate again. 2. Add additional wash steps. |
|
| Background is too high. | Proteins bind nonspecifically to the Anti-Flag monoclonal antibody, the gel beads, or the microcentrifuge tubes. |
1. Pre-clear lysate with Mouse IgG-Agarose (P2055+A7028) to remove nonspecific binding proteins. 2. After suspending beads for the final wash, transfer entire sample to a clean microcentrifuge tube before centrifugation. |
| Washes are insufficient. |
1. Increase the number of washes. 2. Prolong duration of the washes, incubating each wash for at least 15 minutes. 3. Increase the salt and/or detergent concentrations in the wash solutions. 4. Centrifuge at lower speed to avoid nonspecific trapping of denatured proteins from the lysate during the initial centrifugation of the affinity gel complexes. |
相关产品:
| 产品编号 | 产品名称 | 包装 |
| P2271-0.5ml | Anti-Flag Affinity Gel (Anti-Flag亲和凝胶) | 0.5ml |
| P2271-2ml | Anti-Flag Affinity Gel (Anti-Flag亲和凝胶) | 2ml |
| P2271-10ml | Anti-Flag Affinity Gel (Anti-Flag亲和凝胶) | 10ml |
| P9801-1mg | 3X Flag Peptide (3X Flag多肽) | 5mg/ml×0.2ml |
| P9801-5mg | 3X Flag Peptide (3X Flag多肽) | 5mg/ml×1ml |
| P9801-25mg | 3X Flag Peptide (3X Flag多肽) | 25mg |









 微信在线咨询
微信在线咨询












