|
|||||||||
产品简介
产品简介:
| 产品编号 | 产品名称 | 产品包装 | 产品价格 |
| S0052 | 总谷胱甘肽检测试剂盒 | 100次 | 306.00元 |
总谷胱甘肽检测试剂盒(Total Glutathione Assay Kit)是一种简单易行的检测总谷胱甘肽(GSSG+
GSH)的试剂盒。通过谷胱甘肽还原酶把氧化型谷胱甘肽(GSSG)还原成还原型谷胱甘肽(GSH),而GSH可以和生色底物DTNB反应产生黄色的TNB和GSSG。适当配制反应体系,前后两个反应合并起来后,总谷胱甘肽(GSSG+GSH)就相当于一个颜色产生的限速因素,总谷胱甘肽的量就决定了黄色的TNB形成量。从而通过测定A412就可以计算出总谷胱甘肽的量。
本试剂盒的具体反应原理如下:
![]()
![]()
两个反应相合并:
![]()
还原型谷胱甘肽是绝大多数活细胞中巯基的主要来源,对于维护蛋白巯基适当的氧化还原状态有重要作用,并且是动物细胞中关键的抗氧化剂。总谷胱甘肽中通常90-95%为还原型谷胱甘肽。
本试剂盒可以检测动物组织、血浆、红细胞、和培养细胞或其它适当样品中总谷胱甘肽的含量。
本试剂盒提供了蛋白去除试剂S,可以更加准确地测定出含有蛋白的样品中的总谷胱甘肽的量。
本试剂盒的检测下限为1μM。一个试剂盒共可以进行100次检测。
包装清单:
产品编号 |
产品名称 |
包装 |
S0052-1 |
总谷胱甘肽检测缓冲液 |
60ml |
S0052-2 |
谷胱甘肽还原酶 |
150μl |
S0052-3 |
还原型谷胱甘肽(GSH) |
4.5mg |
S0052-4 |
DTNB |
4.5mg |
S0052-5 |
蛋白去除试剂S |
0.4g |
S0052-6 |
NADPH |
4mg |
S0052-7 |
DMSO |
1.5ml |
— |
说明书 |
1份 |
保存条件:
-20℃保存,一年有效。还原型谷胱甘肽配制成溶液后,需适当分装,-20℃保存至少3个月有效。DTNB溶解在DMSO中后,需适当分装,-20℃保存至少3个月有效。蛋白去除试剂S配制成溶液后可以4℃保存。NADPH溶解后,适当分装,-70℃保存。
注意事项:
本试剂盒检测时牵涉到氧化还原反应,所有氧化剂或还原剂都会干扰本试剂盒的测定。特别是DTT、巯基乙醇等含有巯基的试剂会严重干扰本试剂盒的测定,请尽量避免。
一定要严格控制反应时的温度和反应时间,否则需每次都做标准曲线。
NADPH等试剂不太稳定,要严格按照后续说明操作,谨防失活。
DMSO在4℃、冰浴等较低温度情况下会凝固,可以20-25℃水浴温育片刻至全部融解后使用。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明
使用说明:
1. 试剂盒的准备工作:
a.GSH储备液的配制:在本试剂盒提供的4.5mg GSH中加入1.5毫升Milli-Q级纯水,溶解并混匀,即为GSH储备液,浓度为10mM。除立即待用部分外,其余GSH储备液适当分装后-20℃保存。
b.DTNB储备液的配制:在本试剂盒提供的4.5mg DTNB中加入1.5毫升本试剂盒提供的DMSO,溶解并混匀,即为DTNB储备液。除立即待用部分外,其余DTNB储备液适当分装后-20℃保存。
c.蛋白去除试剂S溶液的配制:在本试剂盒提供的0.4克蛋白去除试剂S中加入8毫升Milli-Q级纯水,配制成8毫升5%的水溶液。4℃保存。
d.NADPH储备液(40mg/ml)的配制:在本试剂盒提供的4mg NADPH中加入100微升Milli-Q级纯水,溶解并混匀,即为NADPH储备液。除立即待用部分外,其余NADPH储备液适当分装后-70℃保存。
e.5倍稀释谷胱甘肽还原酶的配制:取50微升谷胱甘肽还原酶,加入200微升总谷胱甘肽检测缓冲液,混匀,即成5倍稀释的谷胱甘肽还原酶。
f.总谷胱甘肽检测工作液的配制:根据待检测的样品数参考下表配制适当量的总谷胱甘肽检测工作液,表中三种试剂按比例混合后即为总谷胱甘肽检测工作液。
|
1个样品 |
10个样品 |
20个样品 |
5倍稀释谷胱甘肽还原酶 |
6.6 μl |
66 μl |
132 μl |
DTNB储备液 |
6.6 μl |
66 μl |
132 μl |
总谷胱甘肽检测缓冲液 |
150 μl |
1.5 ml |
3 ml |
g.0.5mg/ml NADPH的配制:取10微升NADPH储备液,加入790微升总谷胱甘肽检测缓冲液,混匀即为0.5mg/ml NADPH。每检测一个样品需50微升0.5mg/ml NADPH。
2. 标准品的准备:
把10mM GSH储备液用蛋白去除试剂S溶液稀释成50μM GSH溶液。然后依次稀释成25、15、10、5、2μM GSH溶液。取50、25、15、10、5、2μM GSH溶液六个点做标准曲线。注意:由于GSH在蛋白去除试剂S溶液中不太稳定,用蛋白去除试剂S溶液配制的GSH溶液必须新鲜配制后使用,不可冻存后再使用。
3. 样品的准备:
a.组织样品的准备。取组织用液氮速冻,然后研成粉末。每10毫克研碎的组织粉末,加入30微升蛋白去除试剂S溶液,充分Vortex。再加入70微升蛋白去除试剂S溶液,用玻璃匀浆器充分匀浆(对于比较容易匀浆的组织可以不用液氮速冻等处理,而直接加入适量蛋白去除试剂S溶液进行匀浆)。4℃放置10分钟后,10,000g 4℃离心10分钟,取上清用于总谷胱甘肽的测定。样品需暂时4℃保存,不立即测定的样品可以-70℃保存,但不宜超过10天。对于处理好的组织样品通常需用蛋白去除试剂S溶液进行适当稀释后再进行测定,稀释倍数通常为5-20倍。
b.细胞样品的准备。请尽量使用新鲜的细胞进行测定,而不要使用冻存的细胞进行测定。PBS洗涤细胞一次,离心收集细胞,吸尽上清。加入细胞沉淀体积3倍量的蛋白去除试剂S溶液,即如果细胞沉淀为10微升,则加入30微升蛋白去除试剂S溶液,充分Vortex。(细胞沉淀的体积可以根据细胞沉淀的重量进行估算。收集细胞前后分别对离心管进行称重,从而就可以计算出细胞沉淀的重量。10毫克细胞沉淀的体积可以粗略地看做10微升。) 然后利用液氮和37℃水浴对样品进行两次快速的冻融。4℃或冰浴放置5分钟。4℃,10,000g离心10分钟。取上清用于总谷胱甘肽的测定。样品需暂时4℃保存,不立即测定的样品可以-70℃保存,但不宜超过10天。对于处理好的细胞样品通常需用蛋白去除试剂S溶液进行适当稀释后再进行测定,稀释倍数可以高达20倍。
c.红细胞或血浆样品的准备。请尽量使用新鲜的血液进行测定。600g离心10分钟,沉淀为红细胞,上清为血浆。对于红细胞,用PBS洗涤两次。取约50微升红细胞沉淀或血浆,加入50微升蛋白去除试剂S溶液,充分Vortex。4℃或冰浴放置10分钟。4℃,10,000g离心10分钟。取上清用于总谷胱甘肽的测定。样品需暂时4℃保存,不立即测定的样品可以-70℃保存,但不宜超过10天。对于处理好的红细胞样品最后需用蛋白去除试剂S溶液稀释10倍后再进行后续的测定,而对于血浆样品,应直接取10微升进行测定。
d.对于一些谷胱甘肽含量特别低的样品,可以通过冷冻干燥进行浓缩后再进行测定。
4. 样品和标准品的测定:
a.参考下表,使用96孔板,依次加入样品或标准品,混匀。加入150微升总谷胱甘肽检测工作液后,混匀,25℃或室温孵育5分钟。
|
空白对照 (blank) |
标准曲线 (standard) |
样品(sample) |
样品或标准品 |
0 μl |
10 μl |
x μl |
蛋白去除试剂S溶液 |
10 μl |
0 μl |
10-x μl |
总谷胱甘肽检测工作液 |
150 μl |
150 μl |
150 μl |
25℃或室温孵育 |
5 min |
5 min |
5 min |
0.5mg/ml NADPH |
50 μl |
50 μl |
50 μl |
b.加入50微升0.5mg/ml NADPH溶液,混匀。
c.立即用酶标仪测定A412,每5分钟测定一次或实时测定,共测定25分钟,测得5个数据。(说明:为了简化实验步骤,可以在加入NADPH溶液混匀后25分钟,仅测定一次A412)。如果仪器可以设置温度,把温度设置在25℃,否则就在室温状况下测定。如果酶标仪不能测定A412,可以测定405-414nm附近范围的吸光度。如果标准曲线良好,但样品的吸光度比较低,可以延长孵育时间至30-60分钟,标准品和样品的吸光度在一定范围内会随时间的延长接近于线性增加的。
d.标准品的实测效果参考图1。
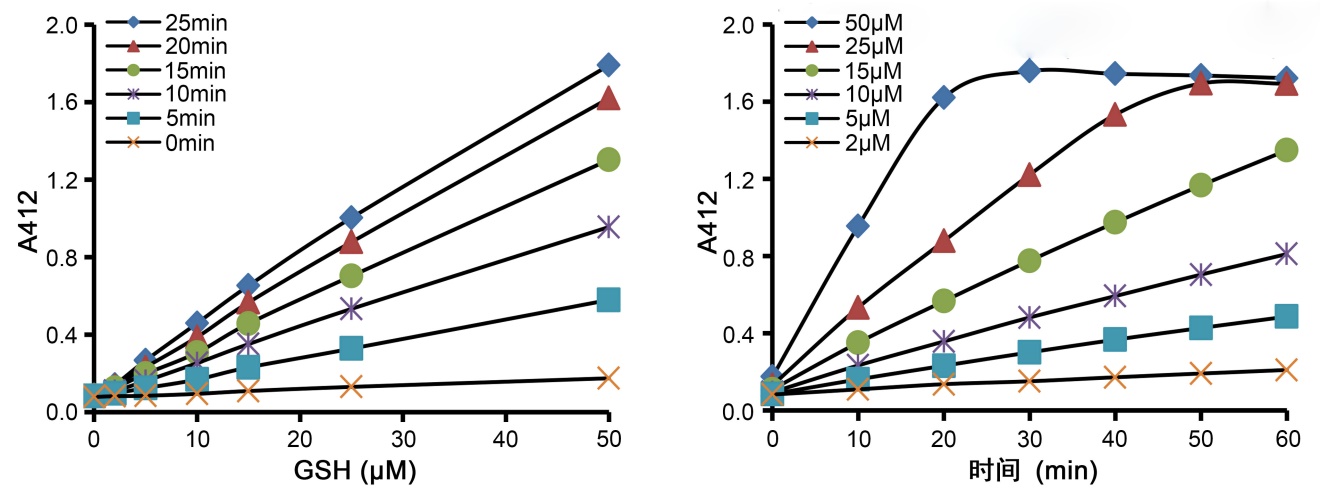
图1. GSH标准曲线实测效果图。图中数据仅供参考,实际的检测效果可能会因具体反应条件的不同而有所不同。
5. 样品中总谷胱甘肽含量的计算:
a.单点测定法:即反应25分钟(或30-60分钟)后仅测定一次吸光度。根据不同浓度标准品测得的不同吸光度作出标准曲线。样品对照标准曲线即可计算出总谷胱甘肽的含量。实际计算出来的总谷胱甘肽的含量相当于把氧化型谷胱甘肽的含量乘以2再加上还原型谷胱甘肽的含量。单点法测定相对比较便捷,而动力学法测定则相对比较精确。
b.动力学测定法:先根据不同时间点测定得到的吸光度值计算出ΔA412/min。然后以标准品的浓度为横坐标,以ΔA412/min为纵坐标,做出标准曲线。根据样品的ΔA412/min,对照标准曲线就可以计算出测定时样品中总谷胱甘肽的含量。
c.同时根据样品的稀释倍数、以及最初样品的使用量,可以计算出每毫克组织或细胞中的总谷胱甘肽的含量。对于细胞样品,也可以根据最初细胞的使用数量,然后另外取一定数量的细胞裂解后测定蛋白浓度,从而计算出细胞样品的蛋白量,最后计算出每毫克蛋白中总谷胱甘肽的含量。
产品图片

相关产品
相关论文
使用本产品的相关论文:
1. Zhao G, Yao-Yue C, Qin GW, Guo LH.
Luteolin from Purple Perilla mitigates ROS insult particularly in primary neurons.
Neurobiol Aging. 2010.
2. Xiao-Long W, Chuan-Ping Y, Kai X, Ou-Jv Q.
Selenoprotein W depletion in vitro might indicate that its main function is not as an
antioxidative enzyme.
Biochemistry (Mosc). 2010;75(2):201-7.
3. Chen L, Sun BB, Wang T, Wang X, Li JQ, Wang HX, Zhang SF, Liu DS, Liu L, Xu D, Ou XM,
Chen YJ, Yang T, Zhou H, Wen FQ.
Cigarette smoke enhances {beta}-defensin 2 expression in rat airways via nuclear
factor-{kappa}B activation.
Eur Respir J. 2010 Sep;36(3):638-45. Epub 2010 Feb 11.
4. Zhang X, Zhao X, Ma Z.
PYDDT, a novel phase 2 enzymes inducer, activates Keap1-Nrf2 pathway via depleting the
cellularlevel of glutathione.
Toxicol Lett. 2010 Nov 10;199(1):93-101.
5. Wu X, Zhu Y, Yan H, Liu B, Li Y, Zhou Q, Xu K.
Isothiocyanates induce oxidative stress and suppress the metastasis potential of human
non-smallcell lung cancer cells.
BMC Cancer. 2010 Jun 9;10:269.
6. Wang J, Sun P, Bao Y, Liu J, An L.
Cytotoxicity of single-walled carbon nanotubes on PC12 cells.
Toxicol In Vitro. 2011 Feb;25(1):242-50.
7. Zhang J, Zhao QZ, Duan GL, Huang YC.
Influence of sulphur on arsenic accumulation and metabolism in rice seedlings.
Environmental and Experimental Botany,2011Aug,72(1),34-40.
8. Bao HG, Wang XY, Li JY, Wu CX.
Comparison of effects of hypoxia on glutathione and activities of related enzymes in
livers of Tibetchicken and Silky chicken.
Poult Sci. 2011 Mar;90(3):648-52.
9. Chen T, Zhang L, Yue JQ, Lv ZQ, Xia W, Wan YJ, Li YY, Xu SQ.
Prenatal PFOS exposure induces oxidative stress and apoptosis in the lung of rat
off-spring.
Reprod Toxicol. 2012 Jul;33(4):538-45.
10.Xu HL, Yu XF, Qu SC, Qu XR, Jiang YF, Sui da Y.
Juglone, from Juglans mandshruica Maxim, inhibits growth and induces apoptosis in
humanleukemia cell HL-60 through a reactive oxygen species-dependent mechanism.
Food Chem Toxicol. 2012 Mar;50(3-4):590-6.
11.Fan S, Yu Y, Qi M, Sun Z, Li L, Yao G, Tashiro S, Onodera S, Ikejima T.
P53-mediated GSH depletion enhanced the cytotoxicity of NO in silibinin-treated human
cervicalcarcinoma HeLa cells.
Free Radic Res. 2012 Sep;46(9):1082-92.
12.Wang J, Sun P, Bao Y, Dou B, Song D, Li Y.
Vitamin E renders protection to PC12 cells against oxidative damage and apoptosis
induced bysingle-walled carbon nanotubes.
Toxicol In Vitro. 2012 Feb;26(1):32-41.
13.Liu JH, Qi ZM, Huang Q, Wei XL, Ke ZG, Fang YS, Tian YC, Yu ZL.
Study of energetic-particle-irradiation induced biological effect on Rhizopus oryzae
through Synchrotron-FTIR micro-spectroscopy.
Journal of Molecular Structure,2012Jan,1031(16),1-8.
14.Lou H, Jing X, Ren D, Wei X, Zhang X.
Eriodictyol protects against H(2)O(2)-induced neuron-like PC12 cell death through
activation of Nrf2/ARE signaling pathway.
Neurochem Int. 2012 Jul;61(2):251-7.
15.Ou XH, Li S, Wang ZB, Li M, Quan S, Xing F, Guo L, Chao SB, Chen Z, Liang XW, Hou Y,
Schatten H, Sun QY.
Maternal insulin resistance causes oxidative stress and mitochondrial dysfunction in
mouse oocytes.
Hum Reprod. 2012 Jul;27(7):2130-45. doi: 10.1093/humrep/des137. Epub 2012 May 3.
16.Li DY, Xue MY, Geng ZR, Chen PY.
The suppressive effects of Bursopentine (BP5) on oxidative stress and NF-?B activation
in lipopolysaccharide-activated murine peritoneal macrophages.
Cell Physiol Biochem. 2012;29(1-2):9-20. doi: 10.1159/000337581. Epub 2012 Mar 1.
17.Wang Y, Wang L, Zhu Z, Ma W, Lei C.
The molecular characterization of antioxidant enzyme genes in Helicoverpa armigera
adults and their involvement in response to ultraviolet-A stress.
J Insect Physiol. 2012 Sep;58(9):1250-8. doi: 10.1016/j.jinsphys.2012.06.012.
Epub 2012 Jun 28.
18.Yang L, Qu M, Wang Y, Duan H, Chen P, Wang Y, Shi W, Danielson P, Zhou Q.
Trichostatin A inhibits transforming growth factor-β-induced reactive oxygen species
accumulation andmyofibroblast differentiation via enhanced NF-E2-related factor
2-antioxidant response element signaling.
Mol Pharmacol. 2013 Mar;83(3):671-80. doi: 10.1124/mol.112.081059. Epub 2013 Jan 2.
19.Liu BN, Yan HQ, Wu X, Pan ZH, Zhu Y, Meng ZW, Zhou QH, Xu K.
Apoptosis induced by benzyl isothiocyanate in gefitinib-resistant lung cancer cells is
associated with Akt/MAPK pathways and generation of reactive oxygen species.
Cell Biochem Biophys. 2013 May;66(1):81-92. doi: 10.1007/s12013-012-9456-9.
20.Lin M, Xia B, Yang M, Gao S, Huo Y, Lou G.
Characterization and antitumor activities of a polysaccharide from the rhizoma of
Menispermum dauricum.
Int J Biol Macromol. 2013 Feb;53:72-6. doi: 10.1016/j.ijbiomac.2012.11.012.
Epub 2012 Nov 16.
21.Zhou Q, Duan H, Wang Y, Qu M, Yang L, Xie L.
ROCK inhibitor Y-27632 increases the cloning efficiency of limbal stem/progenitor cells
by improving theiradherence and ROS-scavenging capacity.
Tissue Eng Part C Methods. 2013 Jul;19(7):531-7. doi: 10.1089/ten.TEC.2012.0429.
Epub 2012 Dec 28.
22.Ji X, Wang H, Zhu J, Zhu L, Pan H, Li W, Zhou Y, Cong Z, Yan F, Chen S.
Knockdown of Nrf2 suppresses glioblastoma angiogenesis by inhibiting hypoxia-induced
activation of HIF-1α.
Int J Cancer. 2014 Aug 1;135(3):574-84. doi: 10.1002/ijc.28699. Epub 2014 Jan 10.
23.Liu X, Chen L, Feng B, Liu G.
Reversing effect of sorcin in the drug resistance of human nasopharyngeal carcinoma.
Anat Rec (Hoboken). 2014 Feb;297(2):215-21. doi: 10.1002/ar.22832. Epub 2013 Dec 24.
24.Gao Y, Li W, Liu X, Gao F, Zhao X.
Reversing effect and mechanism of soluble resistance-related calcium-binding protein on
multidrug resistance in human lung cancer A549/DDP cells.
Mol Med Rep. 2014 Nov 13. doi: 10.3892/mmr.2014.2936.
苏ICP备06009238号 |