1.贴壁细胞
a.取洁净盖玻片在70%乙醇中浸泡5分钟或更长时间,无菌超净台内吹干或用无菌的PBS或0.9%NaCl等溶液洗涤三遍,再用细胞培养液洗涤一遍。将盖玻片置于六孔板内,种入细胞培养过夜,使约为50%-80%满。
b.刺激细胞发生凋亡后,吸尽培养液,加入0.5ml 固定液,固定10分钟或更长时间(可4℃过夜)。
c.去固定液,用PBS或0.9%NaCl 洗两遍,每次3分钟,吸尽液体。洗涤时宜用摇床,或手动晃动。
d.加入0.5ml Hoechst 33258染色液,染色5分钟。也宜用摇床,或手动晃动数次。
e.去染色液,用PBS或0.9%NaCl 洗两遍,每次3分钟,吸尽液体。洗涤时宜用摇床,或手动晃动。
f.滴一滴抗荧光淬灭封片液于载玻片上,盖上贴有细胞的盖玻片,让细胞接触封片液,尽量避免气泡。
g.荧光显微镜可检测到呈蓝色的细胞核。激发波长350nm左右,发射波长460nm左右,图谱请参考下图。
2.悬浮细胞
a.离心收集细胞样品于1.5ml离心管内,加入0.5ml 固定液,缓缓悬起细胞,固定10分钟或更长时间(可4℃过夜)。
b.离心去固定液,用PBS或0.9%NaCl 洗两遍,每次3分钟。洗涤期间手动晃动数次。
c.离心后吸去大部分液体保留约50μl液体,再缓缓悬起细胞,滴加至载玻片上,尽量使细胞分布均匀。
d.稍晾干,使细胞贴在载玻片上不易随液体流动。
e.均匀滴上0.5ml Hoechst 33258染色液,染色5分钟。用吸水纸从边缘吸去液体,微晾干。
f.去染色液,用PBS或0.9%NaCl 洗两遍,每次3分钟,吸尽液体。洗涤时宜用摇床,或手动晃动。
g.滴一滴抗荧光淬灭封片液于载玻片上,盖上一洁净的盖玻片,尽量避免气泡。
h.荧光显微镜可检测到呈蓝色的细胞核。激发波长350nm左右,发射波长460nm左右,图谱请参考下图。
3.组织切片
a.常规包埋切片后,根据切片的不同类型,处理至可以用于免疫组化染色。
b.PBS或0.9%NaCl 洗两遍,每次3分钟,吸尽液体。洗涤时宜用摇床,或手动晃动。可在六孔板中操作。
c.加入0.5ml Hoechst 33258染色液,染色5分钟。也宜用摇床,或手动晃动数次。
d.去染色液,用PBS或0.9%NaCl 洗两遍,每次3分钟,吸尽液体。洗涤时宜用摇床,或手动晃动。
e.小心将切片置于载玻片上,滴一滴抗淬灭封片液,盖上一洁净的盖玻片,尽量避免气泡。
f.荧光显微镜可检测到呈蓝色的细胞核。激发波长350nm左右,发射波长460nm左右,图谱请参考下图。
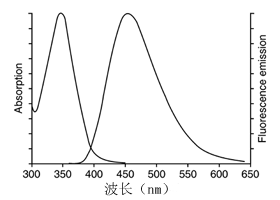
Hoechst 33258的吸收光谱和发射光谱,左侧峰为吸收光谱,右侧峰为发射光谱。