微信在线咨询
微信在线咨询

| 产品编号 | 产品名称 | 产品包装 | 产品价格 |
| C2015S | Calcein/PI细胞活性与细胞毒性检测试剂盒 | 100次 | 112.00元 |
| C2015M | Calcein/PI细胞活性与细胞毒性检测试剂盒 | 500次 | 400.00元 |
| C2015L | Calcein/PI细胞活性与细胞毒性检测试剂盒 | 2500次 | 1613.00元 |
碧云天生产的Calcein/PI细胞活性与细胞毒性检测试剂盒(Calcein/PI Cell Viability/Cytotoxicity Assay Kit,或Calcein/PI Live/Dead Viability/Cytotoxicity Assay Kit)是一种非常便捷的基于Calcein-AM (钙黄绿素)和PI (碘化丙啶)双荧光染色法检测动物细胞死活的试剂盒。
本试剂盒使用便捷,荧光染色和检测仅需约30分钟。本试剂盒染色30分钟后,就可进行后续的荧光显微镜拍照、流式分析或者荧光酶标仪定量等荧光检测和分析。
本试剂盒的原理是两种探针可分别检测细胞内酯酶活性和细胞膜完整性,从而反映细胞活性与细胞毒性。其中Calcein AM染色活细胞,呈现绿色荧光;而碘化丙啶(Propidium Iodide, PI)染色死细胞,呈现红色荧光。本试剂盒用于检测动物细胞活性与细胞毒性效果参考图1。
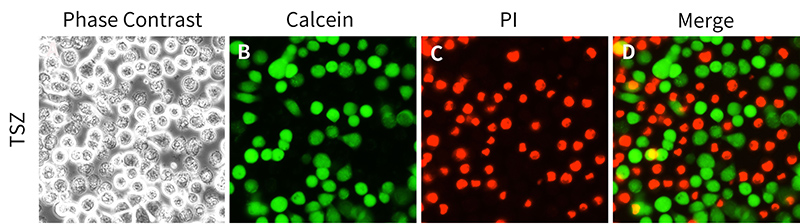
图1. Calcein/PI细胞活性与细胞毒性检测试剂盒用于HT-29(人结肠癌细胞)细胞活性与细胞毒性检测的效果图。HT-29细胞(C6410)在明场视野下仔细观察可以看到有明显的坏死细胞(图A);绿色荧光标记的即为Calcein染色的活细胞(图B),红色荧光标记的即为PI染色的死细胞(图C);Calcein和PI双染叠加(merge)后可以非常清晰地观察到活细胞和死细胞的荧光染色差别(图D)。在本实验中,HT-29细胞经TSZ处理4小时。TSZ为TNFα、SM-164和Z-VAD-FMK组成的细胞程序性坏死诱导试剂(C1058)。实测数据会因实验条件、检测仪器等的不同而存在差异,图中数据仅供参考。
Calcein AM (Calcein Acetoxymethyl Ester,中文名称为钙黄绿素AM或钙黄绿素乙酰氧基甲酯),是一种可以对活细胞进行荧光染色的细胞染色试剂,Calcein AM是在Calcein (钙黄绿素)的基础上增加了乙酰氧基甲酯(AM)基团,加强了疏水性,因此能够很容易穿透细胞膜。Calcein AM本身并没有荧光,进入细胞后被活细胞中内源性酯酶水解生成具有强负电荷的不能通透细胞膜的极性分子钙黄绿素(Calcein),从而被滞留在细胞内,而Calcein可发出强绿色荧光。由于死细胞缺乏酯酶或酯酶活性很低,Calcein AM进入细胞后含有酯酶的活细胞可以产生Calcein,而死细胞不能或很少能产生Calcein,因此仅活细胞会被染色为强绿色荧光,死细胞不能被染色或者染色非常弱。核酸红色荧光染料碘化丙啶(Propidium Iodide, PI)由于不能穿透活细胞的细胞膜,而只能染色细胞膜完整性被破坏的死细胞。因此,Calcein AM与碘化丙啶联合使用,对活细胞和死细胞同时进行双重荧光染色,就能用于细胞活性与细胞毒性的检测。
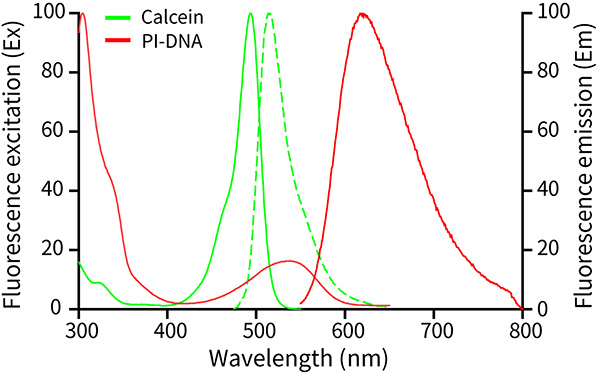
Calcein AM水解产物Calcein的最大激发光波长为494nm,最大发射光波长为517nm;PI-DNA复合物的最大激发光波长为535nm,最大发射光波长为617nm。Calcein和PI-DNA的激发光谱和发射光谱参考图2。
本试剂盒可以用于大多数的哺乳动物细胞的检测。有报道称Calcein AM也可以用于一些植物细胞如拟南芥(Arabidopsis)的根边缘样细胞(root border-like cells)、一些酵母如Pichia anomala和Saccharomyces cerevisiae和一些寄生虫如Leishmania。由于一些寄生虫细胞膜组分比较特殊的原因,Calcein AM不能进入相应的活细胞,但可以进入凋亡早期的寄生虫细胞,从而与PI联用可以用于检测凋亡早期的寄生虫细胞。由于真菌和细菌有细胞壁,会阻碍Calcein进入细胞,因此Calcein AM不适合用于真菌和细菌。本试剂盒与类似用途的台盼蓝染色液相比,更快捷且灵敏度更高。
本试剂盒提供的Calcein AM和PI为1000X溶液,使用非常便捷。并且这两种溶液都经过优化,对大多数细胞都适用,但为得到比较理想的结果,也可根据细胞类型和实验实际情况对Calcein AM或PI在500-2000稀释倍数之间进行适当调整。同时,本试剂盒提供了检测缓冲液,该缓冲液可在一段时间内维持细胞的正常状态,并给细胞提供一定的营养,效果比PBS或HBSS更好。
对于96孔板,按推荐稀释倍数配制相关检测试剂,且每孔使用100μl,此时本试剂盒的小包装、中包装和大包装分别可以检测100次、500次和2500次。
包装清单:| 产品编号 | 产品名称 | 包装 |
| C2015S-1 | Calcein AM (1000X) | 12μl |
| C2015S-2 | PI (1000X) | 12μl |
| C2015S-3 | 检测缓冲液 | 12ml |
| — | 说明书 | 1份 |
| 产品编号 | 产品名称 | 包装 |
| C2015M-1 | Calcein AM (1000X) | 55μl |
| C2015M-2 | PI (1000X) | 55μl |
| C2015M-3 | 检测缓冲液 | 55ml |
| — | 说明书 | 1份 |
| 产品编号 | 产品名称 | 包装 |
| C2015L-1 | Calcein AM (1000X) | 260μl |
| C2015L-2 | PI (1000X) | 260μl |
| C2015L-3 | 检测缓冲液 | 260ml |
| — | 说明书 | 1份 |
-20℃保存,一年有效。Calcein AM (1000X)和PI (1000X)需要避光保存。
注意事项:荧光染料均存在淬灭问题,请尽量注意避光,以减缓荧光淬灭。
Calcein AM (1000X)在潮湿环境中容易分解,首次使用时建议适当分装并-20℃密封保存。
由于Calcein AM在水溶液中不稳定,Calcein AM检测工作液须现配现用,不能配制后冻存。
培养液中的血清和酚红对Calcein AM的染色可能有一定的影响,使荧光背景增强,建议在加入Calcein AM检测工作液前适当洗涤细胞。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
| 10个样品 | 100个样品 | 1000个样品 | |
| Calcein AM (1000X) | 1μl | 10μl | 100μl |
| PI (1000X) | 1μl | 10μl | 100μl |
| 检测缓冲液 | 1ml | 10ml | 100ml |
| Calcein AM/PI检测工作液 | 1ml | 10ml | 100ml |
| 编号 | 组别 | 检测工作液 | 激发波长 | 发射波长 | 结果命名 |
| (1) | 样品组 | Calcein AM/PI | 494nm | 517nm | F(517)sam |
| (2) | 样品组 | Calcein AM/PI | 535nm | 617nm | F(617)sam |
| (3) | 活细胞组 | PI | 494nm | 517nm | F(517)min |
| (4) | 活细胞组 | Calcein AM | 494nm | 517nm | F(517)max |
| (5) | 死细胞组 | PI | 535nm | 617nm | F(617)max |
| (6) | 死细胞组 | Calcein AM | 535nm | 617nm | F(617)min |
| (7) | 无细胞组 | Calcein AM/PI | 494nm | 517nm | F(517)0 |
| (8) | 无细胞组 | Calcein AM/PI | 535nm | 617nm | F(617)0 |









 微信在线咨询
微信在线咨询